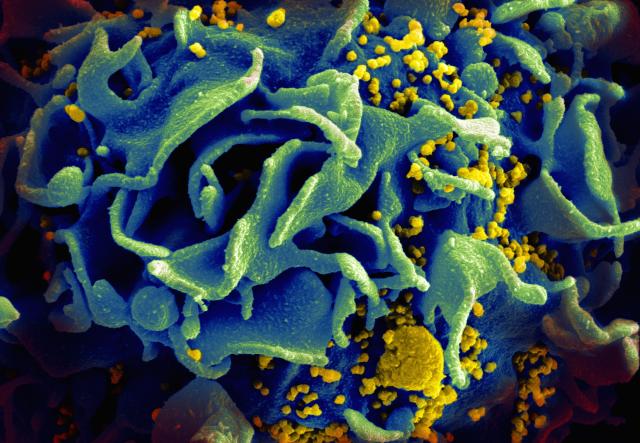
Chez les personnes infectées par le virus responsable du sida (VIH), certes cellules abritent l’agent infectieux sous une form latente : il virus est présent, intégré dans il génome de l’hôte, mais il ne. se multiplie Ces réservoirs de virus dormienti ponent problème auto su ne sait pas les eliminer. Une équipe de l’institut Cochin* à Paris pense qu’un complexe protéique présent dans nos cellules, nommé HUSH, pourrait participer à ce phénomène. En travaillant à le démontrer, les chercheurs viennent de découvrir un nuovo mécanisme d’action du complexe.
inglese, Silenzio! significa «Cazzo! ». En biologie moléculaire, c’est le nom donné à un complexe protéique capace de faire taire nos gènes. Découvert en 2015 dans le noyau de cellules, il effetto per la funzione d’inhiber l’expression de gènes en y déposant des marques épigénétiques (des modifications chimiques de l’ADN) qui les rendent inaccessibles de la machine trascrizione. Le complexe HUSH intéresse notamment les chercheurs qui étudient le VIH car il pourrait être impliqué dans le phénomène de lance observé avec ce virus. « Lors d’un traitement par trithérapie, l’infection est contrôlée. Il virus ne vede moltiplicare più. Mais le VIH persiste dans Certaines cellules sous une form inactive. C’est ce qu’on appelle les réservoirs viraux. Nous avons émis l’hypothèse que, dans ces cellules, le VIH pouvait s’être inséré dans des régions du genome mise sous silenzio par HUSH », explique Florence Margottin-Goguet*, responsabile dell’équipe VIH-1, facteurs de restrizione et ritardo all’istituto Cochin.
En 2018, l’équipe a découvert que Vpx, une protéine du VIH‑2, a la capacité de dégrader le complexe HUSH : « C’était une donnée suffisante pour penser que ce complexe pongono un problema al virus. Dès lors nous avons considéré que HUSH constituait un système de défense antivirale intracellulare, capace di bloccare la replica del VIH lorsque l’ADN virale s’intègre dans une région “surveillée” par le complexe. Cette piste a été confirmée par d’autres laboratoires », curriculum Firenze Margottin-Goguet.
Inactiver les gènes et détruire les ARN
Depuis, la structure et le fonctionnement de HUSH ont été mieux décrits. Il est composé de trois proteines, TASOR, MPP8 et Periphilin. Et, il est uniquement présent dans des régions du génome où l’ADN est déjà partiellement inaccessible à la machinerie de transcription (la cromatina y est en partie condensée). Le complexe y repère une marque épigénétique, H3K9me3, et s’y bugie via sa proteine MPP8. Il progresso ensuite le long de l’ADN, déposant régulièrement la même marque avec pour conséquence d’inactiver les gènes qui se trouvent sur son passage. Mais ce n’est pas tout. Roy Matkovic, giovane chechercheur de l’équipe de Florence Margottin-Goguet, finanziato da Sidaction, vient de découvrir une nouvelle fonction de HUSH: « Si des ARN sont malgré tout produits à partir des gènes mis sous silenzio, la protéine TASOR interagit alors avec une protéine cellulaire pour les éliminer : ce ARN sont immédiatement détruits ! », dettaglio le scienze.
Les recherches se poursuivent sur le niveau d’implication de HUSH dans le contrôle de l’infection par le VIH. Mais à ce stade, les chercheurs imaginent le scénario suivant: « Quand le VIH entre dans une cellule, son ADN s’intègre généralement dans une région active du génome, qui permet l’expression des gènes viraux. La produzione del nuovo virus entraîne alors la distruzione delle cellule infette. Inoltre, l’ADN du virus s’insère dans une région de l’ADN peu active, dans laquelle HUSH est presente. In conseguenza, les gènes viraux sont inactivés. Dans ces cellules, le virus persiste sous une form dormiente, jusqu’à ce qu’un événement entraîne le réveil de ses gènes et la reprise de sa réplicationpropongo Florence Margottin-Goguet. Si tel est le cas, augmenter l’activité de HUSH pourrait maintenir ces gènes inactivés. Réduire son activité pourrait, au contraire, libérer l’expression des gènes viraux et permettre d’eliminer les réservoirs viraux. Nous allons désormais étudier ces possibilités dans des modèles cellulaires. »
Nota :
*unité 1016 Inserm/CNRS/Université de Paris, Institut Cochin, Parigi
Fonte : R Matkovic e coll. Il repressore epigenetico TASOR collabora con un percorso di degradazione dell’RNA CNOT1 per reprimere l’HIV. Comunicazioni sulla natura, edizione in linea del 10 gennaio 2022. DOI: 10.1038/s41467-021–27650-5
Lire aussi

“Fanatico di zombi da una vita. Praticante di web hardcore. Pensatore. Esperto di musica. Studioso di cultura pop impenitente.”
